การทำผิวสีแทน ( Tanning ) ป้องกันอันตรายจากแสงอาทิตย์ไม่ได้
พวกฝรั่งผิวขาว ( Light Skinned People ) พยายามทำให้เกิดผิวสีแทน เพื่อให้เกิดความสวยงามและตามสมัยนิยม ( เมื่อ 40 ปีก่อนฮิตกันมาก ) เป็นวิธีเก่าโดยกระตุ้นให้มีการสร้างเม็ดสีเมลานินในชั้นหนังกำพร้า ( Melanin หรือ Skin Pigment )
การสร้างผิวสีแทน ( Tanning )ไม่สามารถป้องกันอันตรายจากแสงอาทิตย์ได้ ดังนั้น การทำผิวสีแทนในปัจจุบันจึงเลิกนิยม เพราะขณะที่ทำโดยการทาครีมและผึ่งแดดจะด้วยวิธีใดก็ตาม ผิวหนังก็ได้รับอันตรายสะสมจากแสงยูวีไม่มากก็น้อยอย่างแน่นอน [adinserter name=”ความงามและผิวพรรณ”]
ปัจจุบันคนผิวขาวที่อยากมีผิวสีแทนจะเลือกใช้วิธีง่าย ๆ คือเอาน้ำยาย้อมผิว ( Self – Tanning Lotion หรือ Suntan Lotion ) ทาตามตัวให้เกิดสีแทนขึ้นโดยไม่มีการผลิตเมลานิน เลือกความเข้มของสีแทนตามความพอใจและไม่เป็นการย้อมถาวรอีกด้วย โลชั่นสีแทนที่ทาตัวนี้ ( Suntan-Lotion ) ไม่สามารถป้องกันแสงแดด ( Sun Block ) ได้
ผิวหนังของเต้านม ( Breast ) ไม่เคยถูกแดด
จึงเป็นผิวหนังที่สวยงามและดูดีที่สุด ( The Best Looking Skin )
เอกสารทางวิชาการของต่างประเทศกล่าวเหมือนกันหมดว่า คนเราจะมีผิวหนังที่ดูดี คือ บริเวณที่ไม่ถูก แสงแดด ( Sunlight ) เลย ข้อพิสูจน์ที่เห็นได้ชัดคือผิวหนังบริเวณเต้านมของผู้หญิง ( Female Breasts ) ที่บ่งชี้เฉพาะเต้านมผู้หญิงเพราะผู้ชายอาจถอดเสื้อเดินหรือทำงานตากแดด ซึ่งเป็นเรื่องที่ปกติธรรมดาของสังคมโลกมนุษย์ จากเอกสารดังกล่าวยังเสริมอีกว่า ผิวหนังบริเวณเต้านมนั้นจะดูเหมือนผิวหนังเรียบเนียนของเด็กทารกเลยที่เดียว ทั้ง ๆ ที่ไม่เคยต้องใช้เครื่องสำอางราคาแพง ๆ หรืออาศัยเครื่องประเทืองผิวเป็นพิเศษแต่อย่างใดกับผิวหนังบริเวณนี้
โดยสรุปก็คือ ถ้าเราไม่ถูกแสงแดดเลย ผิวหนังก็จะไม่ต้องอาศัยเครื่องสำอางใด ๆ ทั้งสิ้น ตัวอย่างที่เห็นได้ชัด คือ ผิวหนังของเต้านมสตรี จะยังคงสภาพละเอียดอ่อน นุ่มนวล และดูมีสุขภาพดีอยู่เสมอ
การป้องกันอันตรายจากแสงแดดตั้งแต่เด็ก เป็นวิธีที่ควรรีบปฏิบัติเป็นอย่างยิ่ง
สถาบันทางวิชาการของประเทศสหรัฐอเมริการวม 3 แห่ง คือ สถาบันโรคผิวหนัง สถาบันโรคเด็ก และมูลนิธิโรคเนื้องอกผิวหนัง ได้ร่วมกันเสนอแนะว่าการป้องกันผิวหนังไม่ให้ถูก แสงแดด ( Sunlight ) มากเกินไปนั้น ควรจะเริ่มทำตั้งแต่วัยเด็ก สถาบันทั้ง 3 ยังสรุปถึงการใช้สารกันแดดที่มีค่า SPF 15 ควรเริ่มตั้งแต่เด็กอายุ 6 เดือน ( แต่ทางปฏิบัติควรเริ่มตั้งแต่อายุ 6 ขวบ ) และใช้ติดต่อกันอย่างสม่ำเสมอจนถึงอายุ 18 ปี ผลการศึกษาพบว่า จะลดโอกาสเกิดโรคเนื้องอกผิวหนังในช่วงชีวิตที่เหลือลงได้ถึงร้อยละ 78 ( จากวารสารโรคผิวหนังและโรคมะเร็ง ประเทศสหรัฐอเมริกาหน้า 657-660 ค.ศ.1988 หัวเรื่อง The Sun and Sunscreen Protection : Recommendations for Children )
นายแพทย์แซทเชอร์ ( Satcher, D ) ได้รายงานในเอกสารชื่อ “โรคเนื้องอกผิวหนัง” ( Skin Cancer ) ของโครงการเผยแพร่ความรู้เรื่องการป้องกันโรคเนื้องอกผิวหนัง แห่งประเทศสหรัฐอเมริกา ค.ศ.1997 ว่า มนุษย์เราโดยทั่ว ๆ ไปจะโดนแสงแดดมาตั้งแต่อายุได้ 6 เดือน จนถึง 18 ปี เป็นปริมาณสะสมถึง 80 เปอร์เซ็นต์ ของการถูกแสงแดดรวมตลอดชีวิต หลังอายุ 18 ปีไปยาวนานจนกระทั่งแก่กลับถูกแสงแดดน้อยลงคือ มีปริมาณเพียงแค่ 1 ใน 4 ของช่วงเป็นเด็กจนถึงวัยรุ่นนายแพทย์แซทเซอร์ ยังย้ำในตอนท้ายว่า การป้องกันอันตรายของผิวหนังจากแสงแดดจึงควรให้เริ่มตั้งแต่อายุ 6 เดือนขึ้นไปถึงจะเกิดประโยชน์ [adinserter name=”ความงามและผิวพรรณ”]
รังสียูวีที่มากับแสงแดดจะเพิ่มความรุนแรง ถ้ามีการสะท้อนของแสงร่วมด้วย
เดชิโมน ( Desimone EM ) เขียนเอกสารทางวิชาการเกี่ยวกับ ครีมกันแดด ( Sun Screen ) ไว้ในคู่มือการใช้ยาที่ไม่ต้องมีใบสั่งแพทย์ พิมพ์ครั้งที่ 10 ค.ศ.1986 ของสมาคมเภสัชประเทศสหรัฐอเมริกาว่า พื้นผิวของวัตถุบางอย่าง เช่น ทราย ( หาดทรายชายทะเล ) หิมะ ( ภูเขาเล่นสกี ) สามารถสะท้อนรังสียูวีจาก แสงแดด ( Sunlight ) ได้ถึง ร้อยละ 85 ผู้ที่เดินตามชายหาดหรือเล่นสกีบนเขาจึงควรระวังเป็นพิเศษ เมื่อต้องไปในพื้นที่เหล่านั้น ( เพราะทำให้ร่างกายถูกรังสียูวีแรงเพิ่มขึ้นอีก 85 เปอร์เซ็นต์ ) ภายในเวลาเท่ากันกับบริเวณอื่น และควรสวมแว่นตาดำชนิดแอนตี้ยูวี เพื่อถนอมสายตาอีกด้วย
เทเรชา ( Teresa. L ) เขียนเรื่อง “อันตรายจากดวงอาทิตย์” ( Dangers of the Sun ) ของศูนย์ควบคุมสารพิษของรัฐไอโอวา ประเทศสหรัฐอเมริกาได้สรุปถึงอันตรายเพราะแสงแดดจากดวงอาทิตย์ไว้ว่า ความเสี่ยงภัยเพราะถูกแสงแดดกับการเกิดโรคเนื้องอกผิวหนังนั้น ได้มีเอกสารยืนยันเป็นจำนวนมาก ว่าเกี่ยวพันกับการใช้ครีมกันแดดเป็นประจำดูจะช่วยให้ความเสี่ยงอันตรายนี้ลดลง ดังนั้น จึงได้เสนอแนะให้ทุกคนทาครีมกันแดดหรือครีมแอนตี้ยูวี ( Anti UV ) โดยเฉพาะอย่างยิ่งให้ใช้กับเด็ก ๆ ที่อาจต้องถูกแสงแดดด้วย
2. รังสีอุลตร้าไวโอเลต ( Ultraviolet Ray )
ในปี ค.ศ.1666 นักวิทยาศาสตร์สำคัญของโลก ชื่อเซอร์ไอแซค นิวตัน ( Sir lsaac Newton ) ได้ค้นพบคลื่นแสงเป็นครั้งแรก โดยให้ แสงแดด ( Sunlight ) จากดวงอาทิตย์ส่องเข้าไปในห้องมืด ผ่านรูเล็ก ๆ ที่มีแก้วสามเหลี่ยมปริซึม ( Prism ) ขวางไว้ แสงสีขาวของดวงอาทิตย์เมื่อผ่านแก้วปริซึมไปกระทบฝาผนังห้องตรงข้าม จะแตกออกเป็นสีรวมเจ็ดสี คือ แดง ส้ม เหลือง เขียว น้ำเงิน คราม และม่วง แต่ในขณะนั้นยังไม่รู้จักว่าจะยังมีรังสีอื่นที่มองไม่เห็นด้วยตาเปล่าอยู่อีกหรือไม่ นอกจากรังสี 7 สี ของคลื่นแสงที่กล่าวมาแล้ว
รังสีอินฟราเรด ถูกค้นพบก่อนรังสีอุลตร้าไวโอเลต
ในปี ค.ศ.1800 เซอร์ William Hershel ได้พบว่ายังมีคลื่นรังสี ( สายตามองไม่เห็น ) เกินออกมาจากรังสีของแสง เขาสังเกตโดยใช้การวัดความร้อนพบว่า แม้จะเลยสีแดงมาแล้ว ปรอทวัดความร้อนได้ชี้ให้เห็นถึงอุณหภูมิที่สูงขึ้น ทั้ง ๆ ที่ไม่มีแสงมาตกบริเวณนั้น นั่นคือต้องมีรังสีที่อยู่เลยแสงสีแดงออกมาอีก และเขาเรียกรังสีที่เกินแสงสีแดง ( Red หรือ เรด ) นี้ว่า รังสีอินฟราเรด ( Infra Red ) รังสีนี้มีประโยชน์ต่อสุขภาพ มองด้วยตาเปล่าไม่เห็นนอกจากใช้กล้องเฉพาะช่วย ( อย่างในภาพยนตร์ ที่ทหารอเมริกันใช้ตอนกลางคืน ) [adinserter name=”ความงามและผิวพรรณ”]
การค้นพบรังสีอุลต้าไวโอเลต
อีก 1 ปีต่อมา ในปี ค.ศ.1801 นักวิทยาศาสตร์ชื่อ J.W Ritter ได้ศึกษาถึงรังสีที่อยู่อีกปลายของแสง คือ ต่ำกว่ารังสีม่วง โดยใช้ปฏิกิริยาเคมีเป็นตัววัดไม่ใช้ปรอท พบว่ามีพลังงานแต่ไม่ใช่ความร้อน ออกมาในบริเวณที่เกินแสงสีม่วง ทั้ง ๆ ที่ตาเปล่ามองไม่เห็นอะไร รังสีที่เลยสีม่วงออกมานี้ สามารถก่อให้เกิดปฏิกิริยาเคมี นั่นคือจะต้องมีรังสีที่คลื่นแสงต่ำกว่าสีม่วงออกมาด้วย แต่ตาเปล่ามองไม่เห็น Ritter เลยเรียกรังสีต่ำกว่าสีม่วงนี้ว่า รังสีอุลตร้าไวโอเลต ( Ultraviolet ) อุลตร้า ( Ultra ) แปลว่าต่ำกว่าไวโอเลต ( Violet ) แปลว่า ม่วง
รังสีอุลตร้าไวโอเลต ( UV ) ตามธรรมชาติแผ่มาจากดวงอาทิตย์ แต่นักวิทยาศาสตร์สามารถทำรังสี UV เทียมได้ โดยใช้หลอดไฟฟ้าชนิด ไอปรอทที่มีความดันต่ำ ( Low Pressure Mercury Vapour Lamp ) ซึ่งจะให้คลื่นแสงของรังสีอุลตร้าไวโอเลตอยู่ในช่วง 253.7 นาโนมีเตอร์ ( nanometer ) ช่วงคลื่นนี้ทำอันตรายให้กับเชื้อจุลินทรีย์ได้
UVA คือ รังสียูวี ชนิด เอ ( Ultraviolet Light Type A ) มีช่วงความถี่ของคลื่นยาวที่สุดของกลุ่ม คือ อยู่ระหว่าง 320-400 นาโนมิเตอร์ ( nanometer ) คลื่นรังสียูวี เอ สามารถทะลุผิวหนังผ่านชั้นหนังกำพร้า ( Epidermis ) และหนังแท้ ( Dermis ) เข้าไปทำลายคอลลาเจนจึงทำให้ผิวหนังเกิดริ้วรอย นักวิทยาศาสตร์ให้สมญาคลื่นแสงของรังสียูวีช่วงนี้ว่า รังสีจากดวงอาทิตย์ที่ทำให้แก่ ( Sun-Aging Ray ) หรือ UVA โดยคำว่า A ( เอ ) นี้เป็นตัวย่อที่อาจจะมาจากคำว่า Age ( แก่ ) ทำให้จำง่ายขึ้น
คลื่นรังสียูวีเอเป็นคลื่นที่แผ่มายังโลกของเราอย่างสม่ำเสมอตลอดเวลาด้วยความแรงของรังสีเกือบคงที่ ไม่ว่าจะเป็นฤดูกาลอะไรก็ตาม กระจกหน้าต่างรถยนต์ (หรือกระจกธรรมดาทั่วไป) ก็กั้นไม่อยู่ ผิวหนังจะดูดซึมรังสียูวีเอ (UVA) ไว้มากกว่ารังสียูวีบี ( UVB ) ถึง 25 เท่า
อันตรายจากรังสียูวีเอ ( UVA )
รังสียูวีเอ ( UVA ) นี้ทำให้ผิวหนัง ( Skin ) แก่ตัวเร็วขึ้น ( Premature Aging ) โปรตีนคอลลาเจน ( Collagen ) และอีลาสติน ( Elastin ) ในชั้นหนังแท้จะเสื่อมคุณภาพและปริมาณก็ลดลงจนดูเหี่ยว ( Degradation ) เกิดเม็ดสีเมลานินเพิ่มขึ้น และทำให้ผิวหนังมีจุดสีน้ำตาล ( Brown Spot ) กระจายทั่วไปแบบผิวหนังของคนแก่
เมื่อก่อนปี ค.ศ.1980 ( พ.ศ.2523 ) ผู้เชี่ยวชาญทางด้านโรคผิวหนังในขณะนั้นเชื่อกันว่า รังสี UVA ไม่มีอันตรายและยังเป็นประโยชน์ต่อสุขภาพอีกด้วย แต่หลังจากนั้นต่อมาจนถึงปัจจุบันนี้ วงการวิทยาศาสตร์กลับพบว่ารังสียูวีเอ ( UVA ) ทำอันตรายแบบสะสมต่อร่างกายมนุษย์มากกว่ารังสียูวีบี ( UVB ) เพราะร่างกายได้รับตลอดเวลา ไม่ว่าโลกของเราจะใกล้หรือไกลจากดวงอาทิตย์ ความเข้มข้นของรังสียูวีเอนี้เท่ากับรังสีเอ็กซ์อย่างอ่อน ๆ เป็นคลื่นแสงที่ทำให้ สีทาบ้าน เสื้อผ้า สี ซีดลง ( ที่เรียกกันว่าแดดเลียสี ) [adinserter name=”ความงามและผิวพรรณ”]
การที่ผิวหนังแก่ลงกว่าที่ควรเป็นเพราะรังสี UVA แผ่กระจายไปทั่วทุกหนทุกแห่งตลอดปี สามารถทะลุผ่านจนถึงชั้นหนังแท้ ทำลายทั้งคอลลาเจนและอีสาสติน จากเส้นใยที่เคยเต่งตึง กลายเป็นเปราะ ร้าวและหดตัวเหี่ยวลง รวมทั้งสารอุ้มน้ำที่คอยช่วยยึดโปรตีนคอลลาเจนให้อยู่เป็นกลุ่มก็พลอยลดจำนวนลงด้วยผลก็คือชั้นหนังแท้ ( Dermis ) จะแบน ยุบตัว แห้ง กระด้าง กระทบต่อไป จนทำให้ชั้นหนังกำพร้า ( Epidermis ) หยาบกร้านและย่นแบบหนังคนแก่
UVB คือรังสียูวี ชนิด บี ( Ultraviolet Light Type B ) มีช่วงความถี่อยู่ที่ 285-320 นาโนมิเตอร์ ( nanometer – nm ) ที่ใช้คำว่า บี ( B ) ก็เพราะรังสีนี้จะ Burn ( เผาไหม้ ) ผิวหนัง
รังสี UVB นี้เช่นเดียวกับ UVA โดยทั้งสองมีคลื่นแสงยาวกว่ารังสียูวีซี UVC ( ซึ่งจะกล่าวในตอนต่อไป ) สามารถส่องผ่านชั้นบรรยากาศของโลกมาจนถึงผิวดินถึงแม้ว่าจะมีเมฆมืดครึ้ม นั่นคือ ผิวหนังก็เกิดอาการไหม้แดด ( Sunburn ) ได้เมื่ออยู่กลางแจ้ง ถึงจะไม่ได้กระทบกับ แสงแดด ( Sunlight ) โดยตรงก็ตาม
เม็ดสีเมลานิน (Melanin) ป้องกันได้แต่รังสียูวีบี ( UVB ) เท่านั้น
รังสี UVB ซึ่งมีคลื่นแสงสั้นกว่า UVA จะผ่านได้เพียงชั้นหนังกำพร้าเพราะถูกกั้นไว้โดยเม็ดสีเมลานิน แต่ถ้าเม็ดสีไม่มากพอ มันก็จะเลยต่อเข้ามาในชั้นหนังแท้ได้บ้าง ส่วนรังสี UVA นั้น เม็ดสีเมลานิน ( Melanin Pigment ) จะต้านไม่อยู่จึงลงลึกทะลุถึงชั้นหนังแท้ (Dermis) เสมอ เหตุผลนี้สามารถนำไปอธิบายได้ว่า ทำไมครีมทากันแดดทั่ว ๆ ไป จึงได้ผลในการต้านรังสี UVB แต่ไม่เพียงพอในการป้องกันรังสี UVA ยกเว้นผสมตัวยาพิเศษเท่านั้น
รังสี ยูวีบี ( UVB ) มีความแรงไม่เท่ากันตลอดทั้งวัน ผิดกับรังสียูวีเอ (UVA)
รังสี UVA จากดวงอาทิตย์จะสาดส่องเข้มข้นเท่ากันตลอดทั้งวัน ถึงแม้จะมีอากาศมืดครึ้มก็ตาม แต่รังสี UVB จะมีความแรงสูงสุดในช่วง 10.00 นาฬิกา ( 4 โมงเช้า ) จนถึง 14.00 นาฬิกา ( บ่าย 2 โมง ) อย่างไรก็ดีทั้งรังสี UVA (ยูวีเอ) และ UVB ( ยูวีบี ) สามารถทำอันตรายต่อลูกนัยน์ตาอย่างง่ายดาย ( ทั้ง Cornea กระจกตา Lens เลนส์แก้วตา และ Retina จอภาพ ) เมื่อยืนกลางแดด ถึงแม้จะไม่มอง แสงแดด ( Sunlight ) เลยก็ตาม ก็อาจทำให้เกิดต้อกระจก ( Cataract ) และสูญเสียความคมของภาพที่มอง (Visual Acuity Problem) ได้
ถ้าไม่ป้องกันผิวหนังด้วยการทาครีมกันแดด รังสียูวีบีและรังสียูวีเอจะผ่านเข้าไปทำลายเซลล์เม็ดโลหิตขาวขนาดใหญ่ ( Macrophage ชื่อ Langerhans Cell ) มีผลกระทบต่อภูมิต้านทานโรคของผิวหนัง สมรรถภาพในการป้องกันตนเองจะเสื่อมลงจนเชื้อจุลินทรีย์ เช่น ไวรัส หรือแบคทีเรียสามารถเข้าไปทำให้เกิดโรคผิวหนังได้ [adinserter name=”ความงามและผิวพรรณ”]
ผิวหนังที่ช้ำง่าย มีเลือดออกเห็นเป็นจ้ำ ๆ ( Easy Bruising ) เกิดได้เพราะผิวหนังเสื่อมคุณภาพ พบง่ายในผู้สูงอายุ
นักตีกอล์ฟต้องระวัง แสงแดด ( Sunlight ) ให้มาก โดยเฉพาะนักกอล์ฟสตรีถ้าผิวเสียแล้วจะเสียเลย
นักกอล์ฟทั้งหลาย ถ้าไม่มีแพทย์ผิวหนังประจำตัวไว้คอยดูแล อย่างนักกอล์ฟอาชีพต่างประเทศ ควรทราบไว้ว่าผิวของท่านจะทนแสงแดดได้เพียงระดับหนึ่งและในเวลาสั้น ๆ เท่านั้น และมีอันตรายสะสมด้วย เมื่อผิวถูกทำลายโดยรังสียูวีแล้วจะแก้คืนไม่ได้ พออายุเลย 30 ปี ผิวหนังนี้จะเริ่มแสดงความอ่อนแอ หนังแท้ ( Dermis ) ทรุดโทรมและลดการสร้างเซลล์ใหม่ ๆ ( Renew )
ผิวของสุภาพสตรีโดยเฉพาะกลุ่มที่ตีกอล์ฟจะบอบบาง ความรุนแรงของปัญหาจึงมีมาก (Premature Skin Aging) ถ้าไม่คอยเอาใจใส่ดูแลผิวพรรณให้ถูกต้อง ใช้ยาทาผิวไม่มีประสิทธิภาพ ไม่มีอุปกรณ์ป้องกันแดด ถึงแม้มีร่มก็ไม่เพียงพอที่จะกั้นรังสียูวีได้
UVC ( รังสีอุลตร้าไวโอเลตชนิด ซี – Ultraviolet Light Type C )
นักวิทยาศาสตร์บางท่านมักจะเรียกว่า Ultraviolet Cosmic Ray ทำให้จำได้ง่ายว่าเป็นชนิด ซี (C) ซึ่งอยู่ในคลื่นความถี่ 200 – 280 นาโนมีเตอร์ หรือ C Band
คลื่นรังสี UVC นี้ในวงการแพทย์ใช้สำหรับฆ่าเชื้อโรคมานานกว่า 100 ปี จึงมักเรียกอีกชื่อหนึ่งว่า คลื่นรังสีที่ใช้ทำลายเชื้อจุลินทรีย์ ( Germicidal Irradiation – GI ) และเรียก UVC อีกชื่อหนึ่งว่า UVGI
รังสียูวีซีมีคลื่นแม่เหล็กไฟฟ้าสั้นกว่าทั้ง UVB และ UVA และมีฤทธิ์ทำลายรุนแรงกว่า
ดร.นีล ฟินเซน ( Dr.Niels Finsen 1860-1904 ) ได้รับรางวัลโนเบล ( Nobel Prize ) สาขาการแพทย์ เมื่อ ค.ศ.1903
( พ.ศ.2446 ) เป็นคนแรกที่ใช้รังสียูวีซีในการรักษาโรค โดยประดิษฐ์ตะเกียง ชื่อฟินเซนที่ให้รังสียูวี ( Finsen Curative Lamp ) และใช้ติดต่อกันมาจน ค.ศ.1950
รังสียูวีซีจากธรรมชาติ ( ดวงอาทิตย์ ) จะไม่ผ่านชั้นบรรยากาศ จึงไม่มาถึงผิวโลกได้ [adinserter name=”ความงามและผิวพรรณ”]
รังสี UVC นี้มีอำนาจทำลายเซลล์ที่มีชีวิต ( Living Cell ) เพราะสามารถทะลุทะลวงผ่านเยื่อหุ้มเซลล์ ( Cell Membrane ) ทั้งของเชื้อจุลินทรีย์และของมนุษย์ได้อย่างสะดวกสบาย และสามารถเข้าไปถึงแกนกลางของเซลล์ ( Nucleus ) ทำลายรหัสพันธุกรรม คือ DNA ( ดี เอน เอ ) จนเสียหาย ถ้าเป็นสัตว์เซลล์เดียว เช่น แบคทีเรีย ก็จะตายโดยง่าย แต่ถ้าเป็นเซลล์ของสัตว์ชั้นสูง DNA อาจจะทำงานเพี้ยนไปจากปกติได้ และเกิดเป็นเซลล์มะเร็งขึ้น
ยังถือว่าเป็นความโชคดีต่อมนุษย์ชาติ ที่รังสีชนิดนี้ ติดชั้นโอโซน ( Ozone ) ของบรรยากาศที่ปกคลุมโลกอยู่ ไม่ส่องมาถึงมนุษย์บนผิวโลกได้ ยกเว้นในอนาคตที่อาจเกิดสภาวะเรือนกระจก ชั้นโอโซนถูกทำลายจนหนาไม่พอกั้นหรือจะกรองรังสียูวีซีที่มาพร้อมกับ แสงแดด ( Sunlight ) โอกาสนี้มีสูงมากใน 20 ปีข้างหน้า ถึงแม้เกือบทุกประเทศจะให้สัตยาบันในสัญญาเกียวโตแล้วก็ตาม
แสงแดด คือ ตัวทำลายโปรตีนคอลลาเจน ( Collagen )
สุภาพสตรีผู้สนใจปัญหาเรื่องผิวพรรณที่เหี่ยวย่น มีริ้วรอย จะต้องเคยได้ยินคำว่า “คอลลาเจน” บางท่านอาจรู้จักในฐานะเป็นตัวยาผสมในครีมเครื่องสำอางทาผิวชนิดราคาแพง หรือสารโปรตีนใช้ฉีดเข้าในผิวหนังเพื่อขจัดริ้วรอยบนในหน้าเท่านั้น แท้ที่จริงแล้วคอลลาเจนมีคุณสมบัติที่ดีต่อผิวหนังมากกว่านั้น
คอลลาเจนเป็นใยโปรตีนอยู่ในชั้นหนังแท้ จับกันเป็นโครงสร้างพยุงผิวทำให้ผิวหนังเต่งตึง ดูสวยงามน่ามอง คอลลาเจน ( Collagen ) เปรียบเหมือนปุยนุ่นที่ยัดหมอนให้ฟูแต่แน่น ถ้านุ่นน้อยไปหรือมีสภาพแข็ง ไม่อ่อนนุ่ม หมอนก็จะเสียรูปและกระด้าง คอลลาเจนนอกจากจะพบหนาแน่นอยู่ในผิวหนังแล้ว ยังพบได้โดยเป็นโครงสร้างของเนื้อกระดูก ( Bone ) และเอ็น ( Ligament ) แม้แต่ที่ลิ้นหัวใจก็ยังต้องมีคอลลาเจน
คอลลาเจน ( Collagen ) เป็นเช่นเดียวกับเนื้อเยื่อต่าง ๆ ของร่างกาย คือมีสึกหรอและเสื่อมสภาพตามอายุขัย แต่แสงแดดจะกลับเร่งให้การหมดสภาพเร็วยิ่งขึ้นกว่าปกติ จนเซลล์ที่อยู่ในผิวหนังชื่อ Fibroblast ซึ่งมีหน้าที่ผลิตคอลลาเจนขึ้นใหม่เพื่อมาชดเชยที่เสียไปทำงานไม่ทัน ในกรณีที่อายุยิ่งมากขึ้น ความสามารถของเซลล์ Fibroblast ก็ลดลงตามวัยอีกด้วย ซึ่งทั้งหมดนี้ทำให้ใบหน้าเกิดเป็นริ้วรอยถาวรบนใบหน้า ( Face Wrinkle ) [adinserter name=”ความงามและผิวพรรณ”]
มีคอลลาเจนสมบูรณ์ ก็ไม่เกิดริ้วรอยบนใบหน้า
หลักการป้องกันริ้วรอยก็คือ ต้องลดการสูญเสียคอลลาเจน หรือหาวิธีเพิ่มคอลลาเจนขึ้นมาทดแทนส่วนที่ขาดไป การห้ามอายุตัวเราเองไม่ให้มากขึ้นไม่สามารถทำได้ ถึงจะรวยล้นฟ้าก็ทำไม่สำเร็จ แต่การไม่ให้ผิวหนังถูก แสงแดด ( Sunlight ) และเลือกใช้ครีมกันแดดชนิดที่มีคุณภาพนั้นเราสามารถทำได้ อีกทั้งยังเป็นวิธีที่ยึดถือให้ต้องปฏิบัติตามอีกด้วย โดยควรเริ่มทาครีมกันแดดให้ตั้งแต่เด็ก เพื่อป้องกันมะเร็งผิวหนังเมื่อโต
การใช้คอลลาเจน ( Collagen ) ผสมในครีมทาบนผิวหนังพบว่าไม่ได้ผล เพราะโมเลกุลของคอลลาเจน ( Collagen Molecule) จะมีขนาดใหญ่เกินไปไม่สามารถซึมทะลุไปถึงชั้นหนังแท้ ( Dermis ) ได้ มันจะติดค้างบนผิวหนังเท่านั้น และเป็นได้แค่ตัวทำให้ชุ่มชื้น ( Moisturized ) เครื่องสำอางในปัจจุบันจึงได้พัฒนาให้ขนาดโมเลกุลของคอลลาเจนเล็กลงเรียก Microcollagen ( Micro แปลว่า เล็กมาก ) มาใช้ผสมกับครีมทาผิว เพื่อหวังให้แทรกชั้นหนังกำพร้าเข้าไปได้ ชื่อเต็ม ๆ เรียก Microcollagen Pentapeptide แพทย์จะฉีดโปรตีนคอลลาเจนชนิดบริสุทธิ์เข้าไปในผิวหนัง ( Collagen Replacement Therapy ) ตรงบริเวณที่มีริ้วรอย Skin Wrinkle วิธีนี้จะช่วยลบรอยย่นบนใบหน้า การเติมคอลลาเจนโดยใช้ฉีดวิธีดีที่สุดคือ สกัดเอาเซลล์ที่ผลิตคอลลาเจนของตัวเอง (Fibroblast) มาฉีด
โปรตีนของคอลลาเจนบริสุทธิ์ชนิดฉีด ถ้ามีราคาถูกจะผลิตจากสัตว์ ( Animal Source ) เช่น ลูกวัว ดังนั้น มันจะเป็นโปรตีนแปลกปลอมที่เข้าไปในร่างกายมนุษย์ เมื่อฉีดคอลลาเจนที่ผลิตมาจากสัตว์เข้าไป บางคนอาจเกิดอาการแพ้อย่างรุนแรง เพราะภูมิต้านทานในตัวของเราอาจออกมาโจมตีเพื่อกำจัดสิ่งแปลกปลอม ที่เข้ามาปนเปื้อนในกระแสโลหิต นอกจากนี้คอลลาเจนจากสัตว์ที่ฉีดเข้าไป ก็ไม่สามารถผสมกับคอลลาเจนของตัวเราเองได้ ทำให้ตัวคอลลาเจนที่ฉีดเสื่อมสภาพเร็วมาก ( ถ้าไม่สลายอาจก่อให้เกิดเป็นก้อนไตแข็ง ๆ ยิ่งเป็นปัญหามากขึ้น ) ผลก็คือ ริ้วรอยที่หายไปหลังการฉีดจะกลับมาใหม่ ได้ผลการรักษาระยะสั้น ทำให้ต้องฉีดซ้ำ ๆ ซาก ๆ เกือบทุก 3 เดือน
คอลลาเจนรุ่นใหม่ที่ใช้ฉีดจึงมีการพัฒนาโดยทำมาจากมนุษย์ ( Human Collagen ) แทนมาจากลูกวัว ได้ผลดีขึ้น แพ้น้อยลง และไม่ต้องกังวลโรควัวบ้า ( Mad Cow Disease ) อีกด้วย
สำหรับเทคโนโลยีล่าสุด ( New Technology ) คือการสกัดเอาเซลล์ที่ผลิตคอลลาเจนของตัวเอง ( Person, Own Collagen Producing Cell-Fibroblast ) มาเพาะเลี้ยงในห้องปฏิบัติการ ( ห้อง Lab ) จนมีจำนวนพอเพียงจึงนำมาฉีดตรงบริเวณที่มีริ้วรอย วิธีนี้ยุ่งยากและราคาค่อนข้างแพง ผลการรักษาอยู่ในระยะประเมินเบื้องต้น [adinserter name=”ความงามและผิวพรรณ”]
อันตรายจากแสงแดดต่อผิวหนังอย่างร้ายแรง คือ เป็นตัวก่อให้เกิดมะเร็ง
รังสียูวีที่มาพร้อมกับ แสงแดด ( Sunlight ) อาจทำให้ดี เอน เอ ( DNA ) ในนิวเคลียสซึ่งเป็นแกนกลางของเซลล์ผิวหนังมนุษย์เปลี่ยนแปลงไปในทางที่ไม่ดีจนทำงานผิดไปจากปกติ แบ่งตัวเป็นเซลล์ใหม่อย่างเพี้ยน ๆ โดยไม่ยอมอยู่ภายใต้การควบคุม เกิดเป็นเซลล์มะเร็งขึ้น
เซลล์มะเร็งผิวหนัง แบ่งออกเป็น 2 กลุ่ม รวม 3 ชนิดด้วยกัน จัดเรียงตามลำดับโรคเนื้องอกที่พบบ่อยมากขึ้นดังนี้
- เนื้องอกผิวหนังชนิดไม่เกี่ยวข้องกับเม็ดสีเมลานิน (Non-Melanoma Skin Cancer) เนื้องอกชนิดนี้ไม่รุนแรงเป็นเนื้องอกผิวหนังที่ไม่ค่อยมีอันตราย เวลาผ่าตัดเลาะออกก็ง่ายพบบ่อยมากบริเวณใบหน้า หู คอ และแขน ซึ่งเป็นอวัยวะที่ผิวหนังถูกแสงแดดบ่อยที่สุด รังสียูวีเป็นตัวก่อให้เกิดโรคนี้ แพทย์โรคผิวหนังแบ่งเนื้องอกชนิดไม่เกี่ยวกับเม็ดสี Melanin ออกเป็น 2 ชนิดคือ
- มะเร็งของเซลล์บริเวณชั้นฐานหนังกำพร้า ( Basal Cell Carcinoma ) เป็นเนื้องอกผิวหนังที่พบมากที่สุดใน 2 ทศวรรษที่ผ่านมา อัตราการเกิดเนื้องอกชนิดนี้เพิ่มสูงขึ้นมากปีต่อปี ลักษณะของเนื้องอกจะเป็นก้อนเล็ก ๆ มีสะเก็ดนูนสูง โตขึ้นช้า ๆ ไม่มีรากฝังลึก ไม่กระจายไปบริเวณใกล้เคียง (Metastasis) และผ่าตัดง่ายมาก
- มะเร็งของเซลล์หนังกำพร้า ( Squamous Cell Carcinoma )
พบได้มากเช่นกันแต่ก็น้อยกว่าอย่างแรก ลักษณะของเนื้องอกจะเป็นวงสะเก็ด หนา สีแดง มักจะขึ้นนูนบนผิวหนังที่ถูก แสงแดด ( Sunlight ) บ่อย ๆ ตรงกลางตุ่มแตกเป็นแผล บางครั้งอาจกระจายไป ( Metastasis ) ยังบริเวณใกล้เคียง จึงดูจะมีอันตรายมากกว่าชนิด Basal Cell Carcinoma ที่กล่าวมาแล้ว ( A.1 ) แต่ถ้ารีบทำการผ่าตัดรักษาตั้งแต่เมื่อเริ่มเป็น จะปลอดภัยมาก
ผู้ที่ชอบกัดริมฝีปากเล่นเป็นนิสัย ( Lip Biting ) จนมีแผลเรื้อรังและกลายเป็นโรคเนื้องอกชนิดนี้บ่อยมาก
เนื้องอกผิวหนังชนิดเกี่ยวข้องกับเม็ดสีเมลานิน ( Melanoma Skin Cancer ) เนื้องอกผิวหนังชนิดนี้มีอันตรายมากที่สุด [adinserter name=”navtra”]
ความร้ายแรงถึงแก่ชีวิตเลยทีเดียวจึงเรียกชื่อว่า Malignant Melanoma ( โรคมะเร็งเม็ดสีเมลานิน ) และมีอัตราการเกิดโรคเพิ่มขึ้นประมาณ 4 เปอร์เซ็นต์ต่อปี ในประเทศสหรัฐอเมริกาพบผู้ป่วยด้วยโรคนี้เพียง 47,000 ราย จากโรคเนื้องอกผิวหนังชนิดต่าง ๆ ที่ตรวจพบทั้งหมดถึง 1.8 ล้านรายในหนึ่งปี แต่อัตราการตายกลับสูงมาก คือตายด้วยโรคมะเร็ง (Melanoma Skin Cell) ชนิดนี้ถึง 79 รายจากผู้ป่วย 42,000 คน แต่จากการตายด้วยโรคมะเร็งผิวหนังทั้งหมดมีเพียง 100 คนจากเกือบ 2 ล้านคน ถึงแม้การพัฒนาด้านการผ่าตัดจะก้าวหน้ามากเพียงใด แต่ผลของการรักษาก็ยังคงสร้างความผิดหวังไม่เปลี่ยนแปลง ดังนั้น การป้องกันไม่ให้ แสงแดด ( Sunlight ) ทำอันตรายต่อผิวหนังได้จึงเป็นมาตรการที่ดีที่สุดที่ใช้กันอยู่ในปัจจุบัน
พยาธิสภาพของโรคเนื้อร้าย Malignant Melanoma จะเริ่มจากเป็นตุ่มคล้าย ๆ ไฝขนาดใหญ่ หรือ หูด (Mole) ขอบของก้อนเนื้องอกขรุขระไม่ชัดเจน สามารถกระจายไปยังอวัยวะใกล้เคียงได้ จึงทำให้เกิดอันตรายสูง ผู้เชี่ยวชาญสันนิษฐานว่า การถูกแสงแดดจัด ๆ และบ่อย ๆ ตั้งแต่วัยเด็กสะสมมา อาจเป็นสาเหตุทำให้เกิดมะเร็งชนิดนี้ได้เมื่อโตเป็นผู้ใหญ่ คนงานที่ทำงานกลางแจ้งและตากแดดเป็นประจำ จะมีโอกาสเป็นมะเร็งผิวหนังของเม็ดสีเมลานินสูงมากกว่าคนที่ทำงานในร่ม
แนวทางปฏิบัติเพื่อป้องกันมะเร็งผิวหนัง จากมูลนิธิมะเร็งผิวหนังของสหรัฐอเมริกา
The Skin Cancer Foundation ได้ให้คำแนะนำเพื่อปฏิบัติตนดังนี้
- หลบเลี่ยงแสงแดดระหว่างเวลา 10.00 น. ถึง 16.00 น. ( 4 โมงเช้าถึง 4 โมงเย็น )
- สวมหมวกปีกกว้าง
- ใช้ครีมกันแดด ที่มีค่ามากกว่า SPF 15 ทุกครั้งที่ถูกแดด
- เลือกใช้เสื้อผ้าที่ทำด้วยผ้าทอแน่น ( เพื่อไม่ให้รังสียูวีผ่านไปถูกผิวหนัง )
- ใส่เสื้อแขนยาวและนุ่งกางเกงขายาว
- เลือกใส่เสื้อผ้าหลวม ๆ
- ซื้อแว่นกันแดดที่กันรังสียูวีได้
- รีบเข้าอยู่ในที่ร่มทันทีที่สังเกตเห็นว่าเงาของตัวท่านสั้นกว่าตัวจริงของท่าน ( แสดงว่าพระอาทิตย์ส่องเกือบตรง
- ศีรษะของท่านแล้ว ) เพราะเวลานี้รังสียูวีจะแรงมาก
- อย่าใช้สีแทน – Tan ทากันแดด ( เพราะมันไม่ช่วยป้องกันอะไรได้ ) ถ้าทาเพื่อให้สวยสามารถทำได้
- สอนบุตรหลานของท่านให้มีนิสัยป้องกันตนเองจาก แสงแดด ( Sunlight ) อย่างถูกวิธีตั้งแต่ยังเด็กอยู่
- ตรวจความผิดปกติของผิวหนัง ตั้งแต่ศีรษะจรดหัวแม่เท้า ทุก ๆ 3 เดือน
อ่านบทความที่เกี่ยวข้องเพิ่มเติมตามลิ้งค์ด้านล่าง







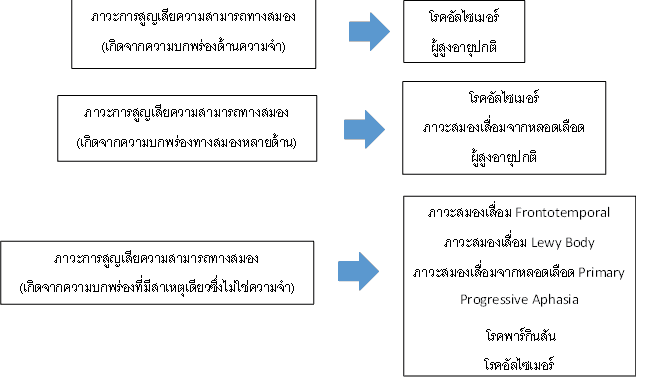
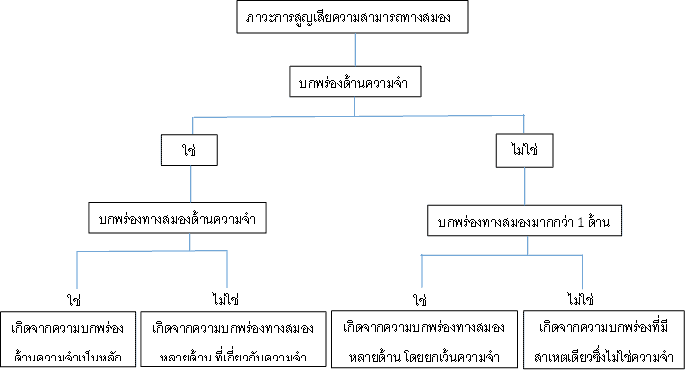 จากแผนภูมินี้สามารถอธิบายได้ถึงวิธีการวินิจฉัยแยกว่าผู้ป่วยมีภาวะการสูญเสียความสามารถทางสมองที่เกี่ยวข้องกับความจำหรือไม่ และอาการบกพร่องเกี่ยวกับด้านความจำเพียงอย่างเดียวหรือมีอาการผิดปกติด้านอื่นร่วมด้วย ซึ่งมีผลในการพิจารณาวิธีรักษาและให้คำแนะนำสำหรับการปฏิบัติตัวของผู้ป่วยต่อไป
จากแผนภูมินี้สามารถอธิบายได้ถึงวิธีการวินิจฉัยแยกว่าผู้ป่วยมีภาวะการสูญเสียความสามารถทางสมองที่เกี่ยวข้องกับความจำหรือไม่ และอาการบกพร่องเกี่ยวกับด้านความจำเพียงอย่างเดียวหรือมีอาการผิดปกติด้านอื่นร่วมด้วย ซึ่งมีผลในการพิจารณาวิธีรักษาและให้คำแนะนำสำหรับการปฏิบัติตัวของผู้ป่วยต่อไป