[adinserter name=”ศัลกรรมความงาม”]
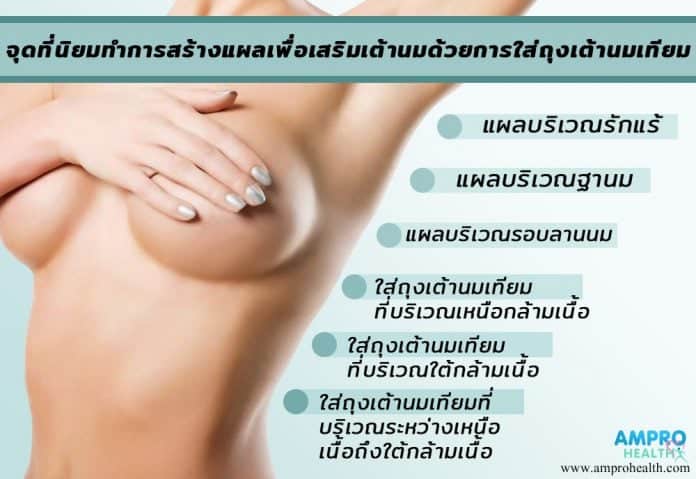
การเสริมหน้าอกต้องทำการเสริมในจุดที่ถูกต้องจึงจะสามารถทำการเสริมหน้าอกได้อย่างสวยงาม ซึ่งจุดที่นิยมทำการสร้างแผลเพื่อเสริมหน้าอกด้วยการใส่ถุงซิลิโคน มีอยู่ด้วยกัน 3 จุด คือ
1.จุดที่บริเวณฐานนม ( InfraMammary Fold; IMF )
การ เสริมหน้าอก ด้วยการสร้างแผลที่ส่วนของฐานมเป็นตำแหน่งที่ปัจจุบันมีการนิยมใช้กันมาก เนื่องจากที่บริเวณนี้สามารถปรับขนาดและตำแหน่งในส่วนฐานนมได้เป็นอย่างดี และเมื่อทำกรเลาะเนื้อเยื่อออกมาแล้วสามารถมองเห็นภายในเต้านมได้อย่างชัดเจน วิธีการเปิดแผลจะต้องทำการผ่าตัดเพื่อทำการแก้ไขด้วยการเปลี่ยนซิลิโคนที่ใส่เข้าไปใหม่ได้ แผลที่เกิดขึ้นจากการผ่าตัดสามารถซ่อนที่บริเวณใต้ฐานของเต้านมทำให้สังเกตเห็นได้ยาก แต่การสร้างแผลที่บริเวณดังกล่าวถ้าแพทย์วางตำแหน่งไม่เหมาะสม อาจจะส่งผลให้รอยแผลเป็นที่เกิดขึ้นสังเกตเห็นได้ชัดเจนเช่นกัน
[adinserter name=”ศัลกรรมความงาม”]
2.จุดที่บริเวณรักแร้ ( TransAxillar;TA )
การ เสริมหน้าอก ด้วยการสร้างแผลที่ส่วนของรักแร้ ( TransAxillar;TA ) การสร้างแผลที่บริเวณรักแร้เพื่อทำการเสริมหน้าอกสามารถช่วยลดความเสี่ยงในการเกิดอาการแทรกซ้อน และรอยแผลที่เกิดขึ้นก็จะสังเกตเห็นได้ยากอีกด้วย การผ่าตัดที่บริเวณรักแร้แม้จะสามารถซ่อนรอยแผลได้แต่เมื่อทำการเปิดแผลแล้วจะสังเกตโครงสร้างของเต้านมได้ยาก ทำให้ไม่การแก้ไขหรือลดขนาดของเต้านมหรือการผ่าตัดเพื่อทำการเลาะพังผืดเพื่อทำการแก้ไขเต้านมจะสามารถทำได้ยาก ต้องอาศัยความชำนาญของแพทย์ที่ทำการผ่าตัดเท่านั้น ส่งผลให้การปรับขนาดของระดับที่บริเวณฐานเต้านม นอกจากนี้ยังมีความเสี่ยงที่ส่วนของระบบทางเดินน้ำเหลืองที่บริเวณรักแร้ ที่อาจมีการรั่วซึมหรือเกิดการอักเสบได้
3.จุดที่บริเวณรอบลานนม ( Periareolar )
การ เสริมหน้าอก ด้วยการสร้างแผลที่ส่วนรอบลานนม ( Periareolar ) การผ่าตัดที่บริเวณรอลานนมสามารถที่จะเสริมขนาดของเต้านมให้มีขนาดตามที่ต้องการและสามารถทำการกระชับผิวหนังที่บริเวณเต้านมให้มีความกระชับเต่งตึงรวมถึงสามารถลดขนาดของลานนมให้มีขนาดตามที่ต้องการได้พร้อมกันด้วย แต่การผ่าตัดที่บริเวณนี้จะมีรอยแผลเกิดขึ้นที่บริเวณรอบลานของหัวนม ทำให้ประสาทรับรู้ที่บริเวณหัวนมเกิดความผิดปกติและอาจจะเกิดความผิดปกติในการให้นมบุตรอีกด้วย จึงทำให้วิธีนี้ไม่นิยมใช้ในการผ่าตัดเพื่อศัลยกรรมนม
การศัลยกรรมเสริมนมให้มีขนาดที่ใหญ่ขึ้น จำเป็นต้องใช้วัสดุใส่เข้าไปในเต้านมเพื่อให้เต้านมมีขนาดใหญ่ขึ้น ซึ่งวัสดุที่นิยมใช้ในการเสริมหน้าอกคือ ถุงซิลิโคน ซึ่งถุงซิลิโคนมีวิธีการใช้ที่ทำการแบ่งตามลักษณะทางภายวิภาคของบริเวณหน้าอก ดังนี้
1.การใส่ซิลิโคน ( ถุงเต้านมเทียม ) ที่บริเวณเหนือกล้ามเนื้อ
คือ การใส่ถุงซิลิโคนที่บริเวณใต้เนื้อของเต้านมโดยตรง โดยทำการใส่ที่บริเวณใต้ชั้นเนื้อยื่อที่อยู่ในส่วนข้างใต้ของเนื้อเต้านม การใส่ถุงที่บริเวณนี้ร่างกายจะมีความรู้สึกเจ็บน้อยมากและต้องใช้เวลาในการพักฟื้นน้อย เพราะกล้ามเนื้อได้รับการกระทบกระเทือนน้อยแต่เต้านมที่สร้างขึ้นจะแลดูไม่เป็นธรรมชาติ เนื่องจากสามารถสังเกตเห็นสันหรือขอบของเต้านมเทียม แต่เห็นบริเวณขอบของเต้านมที่อยู่ด้านบนได้ไม่ชัด โดยเฉพาะในผู้ที่เต้านมมีเนื้อนมในปริมาณที่น้อยและผิวมีคุณภาพที่ไม่ดีนัก และในระยะยาวเต้านมอาจมีริ้วรอยเกิดขึ้นได้หรืออาจเกิดเต้านมแฝดได้ในภายหลัง [adinserter name=”ศัลกรรมความงาม”]
2.การใส่ซิลิโคน ( ถุงเต้านมเทียม ) ที่บริเวณใต้กล้ามเนื้อ
คือ การใส่ถุงซิลิโคนไปยังบริเวณใต้กล้ามเนื้อมัดใหญ่ที่อยู่ทางด้านหน้าของหน้าอก การใส่ถุงซิลิโคนที่บริเวณนี้จะแลดูเป็นธรรมชาติมาก จะไม่สามารถสังเกตเห็นขอบล่างและขอบบนได้ ลักษณะของเนินนมที่เกิดขึ้นจะดูสวยงามและลดความเสี่ยงในการเกิดนมแฝดได้เป็นอย่างดี แต่ว่าการผ่าตัดเพื่อ เสริมหน้าอก ที่บริเวณนี้จะต้องทำการเลาะและตัดกล้ามเนื้อที่บริเวณเต้านมออกบางส่วน ทำให้ร่างกายจะรู้สึกเจ็บปวดเป็นอย่างมาก จึงจำเป็นต้องใช้เวลาพักฟื้นนานและขนาดของซิลิโคนที่นำมาเสริมจะมีขนาดที่จำกัด เพราะกล้ามเนื้อสามารถยืดได้อย่างมีขีดจำกัด เต้านมที่เสริมจึงมีขนาดที่ไม่ใหญ่มากนัก และเมื่อมีการเคลื่อนไหวกล้ามเนื้อก็จะสามารถสังเกตเห็นถุงซิลิโคนได้อย่างชัดเจน
3.การใส่ซิลิโคน ( ถุงเต้านมเทียม ) ที่บริเวณระหว่างเหนือเนื้อถึงใต้กล้ามเนื้อ
คือ การใส่ถุงเต้านมที่บริเวณครึ่งหนึ่งของถุงซิลิโคนอยู่ที่บริเวณใต้กล้ามเนื้อและอีกครึ่งหนึ่งอยู่ใต้ส่วนของเนื้อเต้านมนั่นเอง การผ่าตัดเพื่อใส่ถุงซิลิโคนที่บริเวณนี้ปัจจุบันนิยมใช้กันมาก เพราะลักษณะของเต้านมที่สร้างขึ้นดูเป็นธรรมชาติและสวยงาม ไม่สามารถสังเกตเห็นขอบของถุงเต้านมได้ และถุงซิลิโคนจะอยู่กับที่ไม่เคลื่อนที่ไปยังจุดอื่นได้ แต่การผ่าตัดวิธีนี้ต้องทำการตัดเอากล้ามเนื้อหรือทำการเลาะเนื้อในส่วนของเต้านมบางส่วนออกมากกว่าวิธีอื่น ร่างกายจึงต้องมีการฟักฟื้นนานและมีอาการปวดมากตามไปด้วย
การใส่ถึงเต้านมเทียมสามารถใส่ได้ทุกตำแหน่ง ขึ้นอยู่กับรูปร่าง ลักษณะของเต้านมที่ต้องการเสริม และขนาดของเต้านมที่ต้องการหลังจากการ เสริมหน้าอก ด้วยซิลิโคนแล้วด้วย ซึ่งแพทย์จะเป็นผู้วินิจฉัยตำแหน่งให้กับผู้เข้ารับการผ่าตัด
ถุงซิลิโคนที่เราใช้อยู่ด้วยกันมีอยู่หลายแบบ แต่การแบ่งสามารถแบ่งได้ตามส่วนประกอบของแต่การแบ่งสามารถแบ่งได้ตามส่วนประกอบของถุงเต้านม คือ
1.เปลือกหุ้มที่อยู่ภายนอกของซิลิโคน ( ถุงเต้านมเทียม ) ส่วนของเปลือกถุงซิลิโคนจะทำจากสารซิลิโคน ซึ่งผิวของเปลือกหุ้มจะมีทั้งแบบผิวเรียบ ( smooth surface ) และแบบผิวหยาบคล้ายผิวทราย ( textured surface ) คือ เต้านมเทียมที่มีเปลือกให้สัมผัสที่รู้สึกขรุขระ ซึ่งความหยาบของเปลือกเต้านมเทียมมีตั้งแต่น้อยจนถึงผิวที่หยาบมาก ซึ่งผิวหยาบสามารถช่วยลดพังผืดที่เกิดขึ้นหลังจากใส่ถุงซิลิโคนได้บางส่วน
[adinserter name=”ศัลกรรมความงาม”]
2.วัสดุที่อยู่ภายในของซิลิโคน ( ถุงเต้านมเทียม ) สารที่บรรจุอยู่ภายในถุงซิลิโคนมีอยู่ด้วยการหลายชนิด ได้แก่ น้ำเกลือ ซิลิโคน เจล และน้ำมันพืช ซึ่งน้ำเกลือเป็นวัสดุที่นิยมใช้ใส่ภายในถุงซิลิโคนเป็นอย่างมาก เพราะไม่เป็นอันตรายต่อร่างกาย แต่มีข้อเสียคือเมื่อใช้ไปนาน ๆ แล้วน้ำเกลือจะเกิดการรั่วซึมออกมาทำให้ต้องทำการผ่าตัดใส่ถุงอันใหม่เข้าไปแทน ต่อมาได้มีการพัฒนาใช้ซิลิโคนเจล ที่มีความหนึบ มีความทนทานและความปลอดภัยสูง และถุงซิลิโคนที่ได้มีความเป็นธรรมชาติ
ถุงเต้านมที่นำมาใช้ในการเสริมขนาดหน้าอกมีอยู่ด้วยกันหลายรูปทรง เช่น ทรงกลมพุ่งสูง ทรงกลมพุ่งกลาง ทรงกลมพุ่งต่ำและทรงหยดน้ำ การเลือกใช้จะขึ้นอยู่กับโครงสร้างด้านสรีระ ซึ่งแพทย์ผู้ทำการผ่าตัดจะเป็นผู้แนะนำ ในอดีตได้มีการวิจัยและสรุปออกมาว่าถุงเต้านมมีอายุโดยประมาณของซิลิโคนนจะอยู่ที่ประมาณ 10 ปี แต่ในปัจจุบันด้วยเทคโนโลยีและคุณภาพของซิลิโคนที่นำมาใช้ในการผลิตถุงเต้านมที่มีสูงมาก ทำให้ถุงเต้านมมีอายุที่ยาวนานมากกว่า 10 ปี ซึ่งการที่เราจะรู้ได้ว่าถุงเต้านมที่ใช้อยู่หมดอายุหรือสามารถสังเกตได้จากปฏิกิริยาของร่างกาย ถ้าไม่มีอาการปวดหรืออักเสบแสดงว่าถุงเต้านมยังใช้ได้ หรือสามารถเข้าไปพบแพทย์เพื่อทำการตรวจสอบคุณภาพของถุงเต้านมที่ใช้อยู่ได้เช่นเดียวกัน
ขนาดของถุงเต้านมที่ใส่เพื่อเสริมขนาดของเต้านมให้ใหญ่ขึ้น ใช่ว่าทุกคนจะสามารถใส่ได้ทุกขนาดตามความต้องการ แต่ต้องขึ้นอยู่กับ ความเหมาะสมและลักษณะทางกายวิภาคหน้าอกของตนเองด้วย วิธีการประเมินไซส์ซิลิโคนจะสามารถประเมินได้จากความหนาของเนื้อเต้านม ความกว้างของหน้าอก ที่ทำการวัดจากกระดูกไหปลาร้า กระดูกทรวงอก บริเวณหัวนม บริเวณลานนมและบริเวณฐานเต้านม ซึ่งขั้นตอนและวิธีการแพทย์ผู้ทำการศัลยกรรมจะเป็นผู้คำนวณตามความถนัดของตนเอง ค่าที่คำนวณออกมาได้จะเป็นค่าน้อยสุดถึงค่าที่มากสุดที่ของขนาดเต้านมที่สามารถเลือกขนาดได้นั่นเอง ซึ่งก่อนที่จะทำการเสริมหน้าอกแพทย์ยังจะต้องทำการตรวจร่างกายก่อนทำการผ่าตัดทุกอย่างรวมถึงการตรวจเต้านมเพื่อตรวจหาความเสี่ยงโรคที่เกี่ยวกับเต้านมด้วยทุกครั้ง ซึ่งการตรวจจะเน้นไปที่การตรวจหาโรคและความผิดปกติที่บริเวณกระดูกทรวงอก กล้ามเนื้อ ผิวหนังและต่อมน้ำเหลือง ผู้ที่ต้องเข้ารับการตรวจสามารถแบ่งออกเป็น 3 กลุ่มใหญ่ คือ
[adinserter name=”ศัลกรรมความงาม”]
1.กลุ่มคนมีประวัติ คือ กลุ่มคนที่บุคคลในครอบครัวมีประวัติเป็นโรคเกี่ยวกับเต้านม เช่น มะเร็งเต้านม มะเร็งต่อมน้ำเหลือง หรือเคยได้รับยาฮอร์โมนหรือยาคุมกำเนิดติดต่อกันเป็นระยะเวลาที่นาน ซึ่งอาจมีความเสี่ยงในการเกิดโรคที่บริเวณเต้านมได้
2.กลุ่มที่มีความผิดปกติ คือ กลุ่มที่เคยตรวจพบความผิดปกติที่บริเวณเต้านม เช่น ก้อนเนื้อที่บริเวณเต้านม ผู้ที่มีอาการเจ็บเต้านมบ่อยหรือมากผิดปกติ มีน้ำไหลออกมาจากหัวนมหรือมีแผลเกิดขึ้นที่ผิวหนังของเต้านมโดยไม่ทราบสาเหตุ สำหรับการตรวจเต้านมแล้วพบว่าคนไข้มีก้อนเนื้อต้องทำการตรวจอย่างถี่ถ้วนว่าก้อนเนื้อดังกล่าวเป็นอันตรายต่อร่างกายหรือไม่ ถ้าเป็นก้อนเนื้อที่ไม่เป็นอันตรายก็สามารถทำการเสริมหน้าอกได้
3.กลุ่มที่มีอายุเกิน 35 ปี คนในกลุ่มนี้หากต้องการเสริมหน้าอกจะต้องทำการตรวจคัดกรองโรคที่มีความเสี่ยงที่บริเวณเต้านมอย่างละเอียด
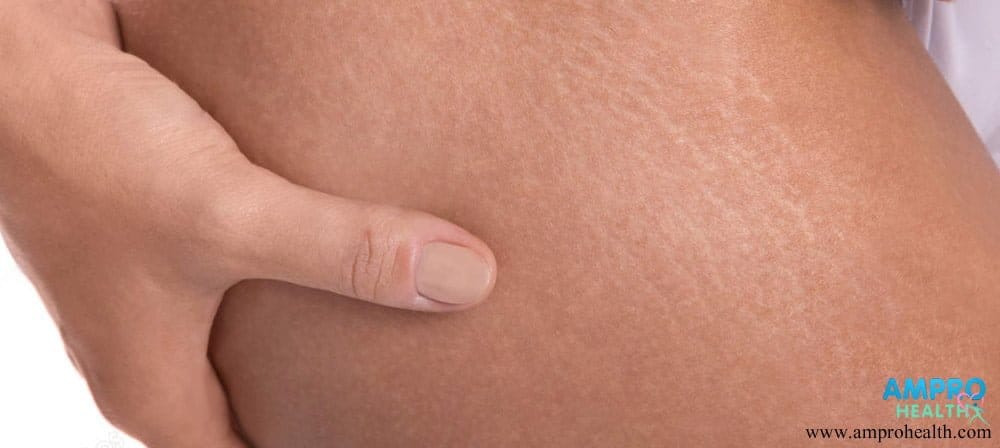
หลายคนที่เข้ารับการผ่าตัดเสริมหน้าอกต้องการเต้านมที่ใหญ่เกิดความจำเป็น แต่แพทย์ไม่ทำการเสริมให้ตามขนาดที่ต้องการ เนื่องจากการเสริมหน้าอกที่มีขนาดใหญ่เกินความจำเป็นจะต้องทำการเลาะเนื้อหรือกล้ามเนื้อให้เกิดช่องว่างที่มีขนาดใหญ่ตามขนาดของซิลิโคน จึงมีความเสี่ยงที่เส้นประสาทและเส้นเลือดจะถูกตัดออก ส่งผลให้เกิดอาการชา เลือดออกมากและมีอาการเจ็บปวดมาก และในระยะยาวจะมีอาการ ผิวหนังแตกลาย หนังเกิดการยืดคราก เต้านมมีการย้อยต่ำมากกว่าปกติ เต้านมมีลักษณะเป็นลอนคลื่นอย่างเห็นได้ชัด บริเวณหัวนมและเต้านมมีความรู้สึกชาหรือไร้ความรู้สึก การแก้ไขปัญหาที่เกิดขึ้นทำได้ด้วยการผ่าตัดใหญ่เท่านั้น และบางปัญหาไม่สามารถแก้ไขให้เต้านมกลับมาสวยงามเช่นเดิมได้
การเสริมหน้าอกต้องทำการเสริมในจุดที่ถูกต้องจึงจะสามารถทำการเสริมหน้าอกได้อย่างสวยงาม ซึ่งจุดที่นิยมทำการสร้างแผลเพื่อเสริมหน้าอกด้วยการใส่ซิลิโคน
ผู้ที่สามารถทำการเสริมหน้าอกได้ควรมีอายุตั้งแต่ 18 ปีบริบูรณ์ขึ้นไป สำหรับหญิงที่ให้นมบุตรควรหยุดให้นมบุตรหรือหยุดปั้มนมอย่างน้อย 6 เดือนเพื่อที่เต้านมจะกลับเข้าสู่สภาพปกติก่อนที่จะมีน้ำนมหรือผู้ที่อยู่ในสภาวะการเปลี่ยนแปลงของน้ำหนักไม่ว่าจะเป็นการลดน้ำหนักหรือเพิ่มน้ำหนักต้องรอให้น้ำหนักคงที่อย่าองน้อย 6 เดือนเช่นเดียวกัน เพื่อที่ขนาดของซิลิโคนที่เสริมเข้าไปจะได้พอดีกับขนาดของลำตัวนั่นเอง ผู้ที่ทำการเสริมหน้าอกแล้วเมื่อตั้งท้องก็สามารถให้น้ำนมบุตรได้ตามปกติแต่ปริมาณน้ำนมที่มีอยู่อาจจะน้อยกว่าคนที่ไม่ได้เสริมหน้าอกอยู่บ้าง [adinserter name=”ศัลกรรมความงาม”]
ก่อนที่ทำการผ่าตัดผู้เข้ารับการผ่าตัดต้องเตรียมตัวเพื่อเข้ารับการผ่าตัด ดังนี้
1.งดสูบบุหรี่หรือดื่มเครื่องดื่มที่มีแอลกอฮอล์อย่างน้อย 3 สัปดาห์- 1 เดือนก่อนเข้ารับการผ่าตัด
2.งดรับประทานยา อาหารเสริม วิตามินทุกชนิด
3.งดอาหารและเครื่องดื่มทุกชนิดก่อนการเข้ารับการผ่าตัด 6-8 ชั่วโมงก่อนเข้ารับการผ่าตัด
4.แจ้งแพทย์ทุกครั้งถ้ามีอาการแพ้ยาหรือสารเคมีตัวใด เพื่อที่แพทย์จะได้หลีกเลี่ยงการใช้ที่อยู่ในกลุ่มดังกล่าว
5.เลือกสถานที่ให้บริการที่ได้รับมาตรฐานชัดเจนเพื่อความปลอดภัยของชีวิต และลดความเสี่ยงในการเกิดอาการแทรกซ้อน
นอกจากการ เสริมหน้าอก ด้วยการใส่เต้านมเทียมแล้ว ยังมีการเสริมหน้าอกด้วยการฉีดไขมันเข้าสู่เต้านม
ซึ่งการฉีดไขมันเพื่อเสริมขนาดของเต้านมจะทำการดูดไขมันจากส่วนอื่นของร่างกายมาทำการฉีดเข้าสู่เต้านมเพื่อเพิ่มขนาดของเต้านม แต่เมื่อทำการฉีดไขมันเข้าไปแล้ว ไขมันจะมีการยุบตัวลงและสลายตัวสูงสุดถึงร้อยละ 70 การฉีดไขมันจึงคงอยู่ไม่นานและขนาดที่สามารถเพิ่มขึ้นได้ก็ไม่ใหญ่มากเหมือนกับการเสริมด้วยซิลิโคน การฉีดไขมันเข้าสู่เต้ามีการใช้กันมาอย่างยาวนานเพื่อรักษาความผิดปกติของเต้านม เช่น เต้านมที่มีเนื้อบางมาก เต้านมที่มีผิวเป็นลอนคลื่น เต้านมที่มีพังผืด เป็นต้น ซึ่งการฉีดไขมันจะสามารถแก้ไขปัญหาได้บางส่วนเท่านั้น ข้อดีของการฉีดไขมันคือมีความเสี่ยงในการเกิดปฏิกิริยาการต่อต้านน้อยเนื่องจากเป็นส่วนหนึ่งของร่างกายอยู่แล้วเพียงแต่ย้ายที่อยู่เท่านั้นเอง ปัจจุบันได้มีการนำฟิลเลอร์มาฉีดเพื่อเพื่อขนาดของเต้านม ซึ่งการนำฟิลเลอร์มาฉีดเข้าสู่เต้านมจัดเป็นอันตรายต่อร่างกายมาก เพราฟิลเลอร์ไม่สามารถสลายได้เอง จึงเกิดสารตกค้างทำให้เต้านมเกิดอาการอักเสบซึ่งบางครั้งไม่สามารถทำการรักษาได้จนต้องทำการตัดเต้านมทิ้งก็มี
เมื่อเข้ารับการผ่าตัดแล้วผู้ปวยจะต้องพักฟื้นประมาณ 7-14 วันจึงจะสามารถทำกิจวัตรประจำวันได้ตามปกติ และอาการปวดจะเกิดขึ้นเพียงแค่ะ 2-5 วันแรกหลังจากการผ่าตัดเท่านั้น ซึ่งแพทย์จะให้ยาแก้ปวดและลดอาการอักเสบ [adinserter name=”ศัลกรรมความงาม”]
ในการผ่าตัดถ้ามีการเตรียมความพร้อมของร่างกายไม่ดี หรือเกิดความผิดพลาดในขณะที่ทำการผ่าตัดก็อาจเกิดอาการแทรกซ้อนได้ ดังนี้
1.อาการชา
อาการชาอาจเกิดขึ้นเนื่องจากมีการตัดเส้นประสาทที่บริเวณเต้านมโดยที่ไม่ได้ตั้งใจ ซึ่งอาการดังกล่าวจะหายไปเองหลังจากเข้ารับการผ่าตัด 3-6 เดือน
2.อาการเสียว
อาการเสียวเกิดขึ้นจากการที่เส้นประสาทที่บริเวณเต้านมเกิดการยึดหรือตึง หรือบริเวณปลอกเส้นประสาทมีอาการบาดเจ็บ ซึ่งอาการเสียจะหายไปได้เองหลังจากเข้ารับการผ่าตัดประมาณ 2-3 สัปดาห์
3.อาการนมแฝด
คือ ภาวะที่นมมีการชิดกันมากเกินไป ซึ่งมีลักษณะเหมือนเต้านมแฝด เกิดจากการที่ฐานของเต้านมทั้ง 2 ข้างเชื่อมติดกัน ทำให้นมไม่มีกล้ามเนื้อตรงกลางทำการแบ่งเต้าทั้งสองออกจากัน สาเหตุของการเกิดเต้านมแฝด คือ
1.ซิลิโคนที่ใส่เข้าไปในเต้านมมีขนาดที่ใหญ่มากเกินไป
2.ทำการใส่ซิลิโคนที่บริเวณเหนือกล้ามเนื้อ
3.มีการเลาะโพรงที่บริเวณใกล้กับตรงกลางของส่วนของกระดูกจนชิดกันมากเกินไป
4.เนื้อเยื่อมีการสูญเสียความยืดหยุ่น
[adinserter name=”ศัลกรรมความงาม”]
5.หลังจากการผ่าตัดที่บริเวณโพรงของถุงซิลิโคนมีอาการครากและยืดตัวออก ที่มักเกิดจากได้รับการนวดที่รุนแรง
6.เกิดแต่กำเนิดเนื่องจากตัวผู้ป่วยหรือผู้ป่วยมมีขนาดของเต้านมและน้ำหนักของเต้านมที่มากผิดปกติ
ซึ่งการแก้ไขอาการนมแฝดนี้ทำได้ยาก ส่วนมากแพทย์จะแนะนำวิธีป้องกันก่อนที่จะทำการ เสริมหน้าอก เพื่อลดความเสี่ยงและในการเสริมหน้าอกไม่ควรเสริมด้วยการใส่ซิลิโคนที่มีขนาดใหญ่มากเกินและไม่ทำการนวดที่รุนแรงในบริเวณเต้านม แต่เมื่อมีการเกิดนมแฝดขึ้นแล้ว จะต้องผ่าตัดเพื่อเอาเต้านมเก่าออกและทำการเสริมหน้าอกใหม่เข้าไปแทนที่ ซึ่งถือว่าเป็นวิธีการที่ยากมาก ส่วนมากจะต้องทำการดูดนมเก่าออกและพักร่างกายแล้วจึงจะสามารถทำการเสริมหน้าอกใหม่ได้ในภายหลัง
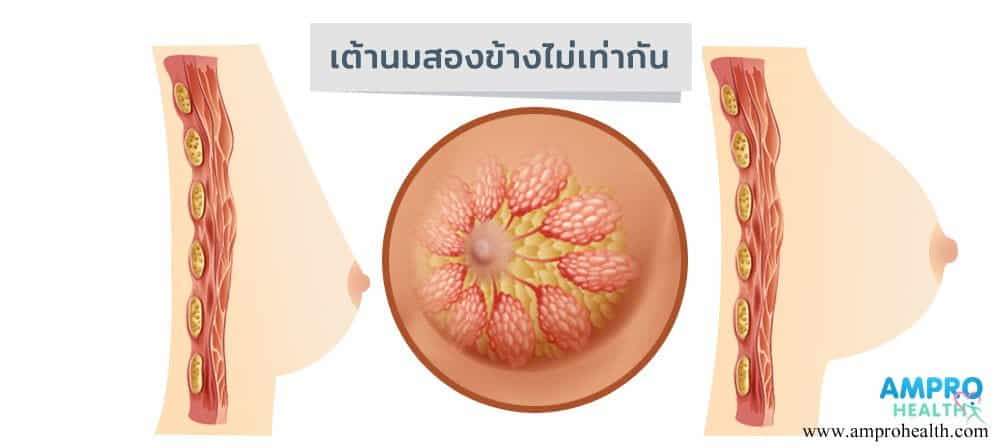
4.อาการนมห่าง
คือ สภาวะที่เต้านมมีความห่างมากกว่าที่ควรจะเป็น ซึ่งสาเหตุของเต้านมห่างเกิดขึ้นจาก
1.โครงสร้างของกระดูกที่บริเวณหน้าอกที่นูนและมีการออกห่าง หรือที่เรียกว่า “อกอกถังเบียร์”
2.มีเนื้อที่บริเวณเต้านมน้อย จึงทำให้เต้านมห่างออกจากัน
3.มีการเกิดพังผืดที่บริเวณเต้านมเทียม พังผืดจึงทำการรั้งซิลิโคนให้ออกห่างจากกัน
4.ขนาดของถุงซิลิโคนมที่ใช้ในการ เสริมหน้าอก มีขนาดเล็กเกินไป
5.บริเวณที่ทำการใส่ซิลิโคนอยู่ห่างกันมากเกินไป
ซึ่งอาการนมห่างสามารถแก้ไขอด้วยการเลาะเอาซิลิโคนให้มาอยู่ใกล้กันมากขึ้น หรือทำการใส่ซิลิโคนให้มีขนาดใหญ่ขึ้น หรือทำการฉีดไขมันเข้าไปเพื่อช่วยเพิ่มปริมาณของเนื้อที่อยู่ด้านในและเพิ่มขนาดของ เนินนม ให้มากขึ้น นมจะได้ชิดกันมากขึ้น แต่ถ้ามีความผิดปกติมากจากโครงสร้างของกระดูกจะไม่สามารถแก้ไขได้
การเสริมหน้าอกสามารถทำการเสริมได้ทั้งผู้หญิงและผู้ชาย แต่ขั้นตอนและวิธีการผ่าตัดเพื่อเสริมหน้าอกจะมีความแตกต่างกันขึ้นอยู่กับลักษณะของร่างกายนั่นเอง [adinserter name=”ศัลกรรมความงาม”]
การปฏิบัติตนให้เต้านมหายและได้รูปทรงที่สวยงามหลังผ่าตัด
ผู้ที่ทำการ เสริมหน้าอก มาแล้ว สิ่งที่มีความจำเป็นก็ คือ เสื้อชั้นใน ที่ต้องใส่ติด เต้านม อยู่เสมอ การใส่เสื้อชั้นในก็เพื่อลดอาการอักเสบ เพิ่มความกระชับให้กับเต้านม และลดอาการบวมได้เป็นอย่างดี จึงควรเลือกใส่เสื้อชั้นในที่มีความยืดหยุ่นและกระชับพอดีกับเต้านม อย่าใส่เสื้อช้นในที่คับหรือหลวมจนเกินไป และผู้ที่ทำการเสริมหน้าอกมาแล้วสามารถออกกำลังกายได้หลังจากทำการผ่าตัดมาแล้วประมาณ 1 -1.5 เดือน และควรเลือกออกกำลังกายเบา ๆ ก่อน เพื่อให้ร่างกายปรับตัวกับขนาดของเต้านมที่มีขนาดเพิ่มขึ้น ลดความเสี่ยงในการเกิดการอักเสบขณะออกกำลังกาย หรือบางท่านต้องการทำการนวดเพื่อให้กล้ามเนื้อเต้านมมีควมยืดหยุ่นรับกับวัสดุที่เสริมเข้าไปในเต้านม ซึ่งการนวดสามารถทำได้แต่ควรเป็นการนวดเพียงเบา ๆ เท่านั้น และควรนวดเพียงรอบเดียวต่อวันอย่านวดซ้ำวนไปมา เพราะเต้านมอาจเกิดการอักเสบจากการนวดได้ เต้านมที่ทำการผ่าตัดมาจะกลับเข้าสู่สภาวะปกติประมาณ 2-3 เดือนหลังจากเข้ารับการผ่าตัด ซึ่งผู้ที่เข้ารับการผ่าตัดก็จะต้องปฏิบัติตนดังนี้ เพื่อให้เต้านมหายและได้รูปทรงที่สวยงาม
1.นอนหงายหรือนอนตะแคง
หลังจากผ่าตัดแล้วควรนอนด้วยท่านอนหงายหรือนอนตะแคงเท่านั้น ห้ามนอนคว่ำ โดยเฉพาะในช่วง 1-3 สัปดาห์หลังจากเข้ารับการผ่าตัดแล้ว และควรใส่เสื้อชั้นนอนเพื่อช่วยพยุง เต้านม ให้อยู่กับทีไม่เคลื่อนที่ไปมาขณะที่นอนหลับ
2.งดเครื่องดื่มแอลกอฮอล์และสูบบุหรี่ อย่างน้อย 3 สัปดาห์หลังจากการผ่าตัด เสริมหน้าอก เพื่อที่แผลจะได้สมานตัวเร็วขึ้น และลดการเกิดพังผืดที่ทำให้เกิดการบวมของเนื้อที่บริเวณเต้านม หรือการคั่งของเลือดและน้ำภายในเต้านม
3.รับประทานอาหารที่สด สะอาด เช่น ไข่ไก่ อาหารทะเล หมู ปลาผักและผลไม้สามารถรับประทนได้ทุกชนิด
4.งดอาหารหมักดอง เพื่อลดความเสี่ยงในการได้รับสารพิษที่อยู่ในอาหารหมักดอง
สำหรับผู้ที่ทำการ เสริมหน้าอก แล้วไม่ต้องกลัวว่าจะเป็นมะเร็งเต้านม เนื่องจากมีการทำสถิติพบว่าผู้ที่ไม่ได้ทำการเสริมหน้าอกพบว่าเป็นมะเร็งเต้านมใกล้เคียงกับผู้ที่ทำการเสริมหน้าอก จึงสรุปได้ว่าการเสริมหรือไม่เสริมหน้าอกไม่มีผลต่อการเป็นมะเร็ง ผู้ที่ทำการเสริมหน้าอกสามารถทำการตรวจแบบเมมโมแกรมและอัตราซาวด์ได้ปกติ แต่ต้องมีการตรวจแบบอื่นร่วมด้วย ผลที่ได้จากการตรวจจึงจะมีความแม่นยำ และผู้ทำการเสริมหน้าอกไม่จำเป็นต้องพบแพทย์เพื่อทำการตรวจเป็นประจำ แต่ถ้าเต้านมมีความผิดปกติ เช่น รูปร่างเปลี่ยนไป รู้สึกมีน้ำรั่วซึม หรือเกิดรอยแผลต้องรีบไปพบแพทย์ในทันที [adinserter name=”ศัลกรรมความงาม”]
นอกจากการเพิ่มขนาดของเต้านมแล้ว ยังมีการ ศัลยกรรมเต้านม อีกอย่างหนึ่ง คือ การลดขนาดของเต้านม ซึ่งการลดขนาดของเต้านมจะทำในคนที่มีขนาดเต้านมใหญ่ จนทำให้เกิดอาการปวดคอ ปวดไหล่ ปวดหลัง หรือมีเชื้อราเกิดขึ้นที่บริเวณใต้ราวนม หรือในผู้ที่มีความผิดปกติของเต้านม เช่น ในผู้ชายที่มีเต้านมโตเนื่องจากความผิดปกติจากฮอร์โมนทำให้นมโตหรือการเกิดเนื้องอกที่บริเวรเต้านม หรือในผู้ที่ต้องการแปลงเพศ่จากผู้หญิงเป็นผู้ชาย ซึ่งแพทย์จะต้องทำการประเมินทั้งด้านจิตใจและร่างกายก่อนทำการผ่าตัดร่วมด้วย
ซึ่งการผ่าตัดลดขนาดของเต้านมมีข้อควรระวังดังนี้
1.เส้นประสาทที่บริเวณหน้าอกหายไปทำให้หน้าอกไม่มีความรู้สึก
2.แผลที่เกิดขึ้นจากการผ่าตัดมีขนาดที่ใหญ่มาก จึงมีความเสี่ยงในการเกิดรอยแยกของแผล การติดเชื้อ และเนื้อตายได้
3.ในระยะยาวเต้านมอาจมีขนาดที่ใหญ่ขึ้นได้ จึงต้องทำการผ่าตัดซ้ำอีก
สำหรับผู้ที่มีความผิดปกติที่เต้านม เช่น เกิดก้อนเนื้อหรือก้อนเนื้อร้อยที่บริเวณเต้านม เมื่อทำการตัดเต้านมทิ้งไปแล้วสามารถทำการเสริมขนาดของเต้านมให้กลับมามีชนาดที่เท่าเดิมได้ ด้วยการใช้เทคนิคการเอาเนื้อส่วนอื่อนของร่างกายมาทำการตัดปะที่บริเวณเต้านมหรือการนำเต้านมเทียมมาใช้แทนก็ได้เช่นเดียวกัน
นอกจากการผ่าตัดเพื่อลดขนาดเต้านมแล้วยังสามารถยังสามารถทำการผ่าตัดเพื่อปรับปรุงลักษณะของเต้านมได้อีก ดังนี้
1.ผ่าตัดลดขนาดลานนม
การผ่าตัดเพื่ลดขนาด ลานนม ทำได้ด้วยการฉีดยาชาและทำการเย็บรอบบานนมให้มีขนาดที่เล็กลง ซึ่งการผ่าตัดลดลานนมสามารถทำการกระชับเต้านมให้มีความเต่งตึงมากขึ้นด้วย
2.การผ่าตัดลดขนาดของหัวนม
ด้วยการผ่าตัดเอาเนื้อบางส่วนของหัวนมออกไปและทำการเย็บแผล การผ่าตัดลดขนาดหัวนมจะทำให้หัวนมชาหรือมีความรู้สึกน้อยลง และผู้ที่ให้นมบุตรน้ำนมอาจจะไหลน้อยลงเนื่องจากช่องทางออกของน้ำนมน้อยลงนั่นเอง [adinserter name=”ศัลกรรมความงาม”]
3.การผ่าตัดแก้หัวนมบอด
หัวนมบอดสามารถแก้ไขได้ด้วยการฉีดไขมันในกรณีที่หัวนมบอดเล็กน้อย แต่ถ้าหัวนมบอดลึกมากต้องทำการผ่าตัดเพื่อดึงหัวนมออกมา
เมื่อทำการผ่าตัด เสริมหน้าอก มาแล้ว และผ่านไปสักระยหนึ่งร่างกายมีความเปลี่ยนแปลงตามอายุ ผิวหนังเริ่มมีความหย่อนคล้าย ทำให้เต้านมเกิดความหย่อนยานจึงจำเป็นต้องทำการยกกระชับเต้านมเพื่อให้เต้านมมีรูปทรงที่สวยงาม ซึ่งการยกกระชับเต้านมมีอยู่ด้วยกันดังนี้
1.การร้อยไหม คือการนำไหมหลาย ๆ เส้นเข้าไปไว้ภายในเต้านมและนำไปแขวนไว้กับกระดูกส่วนของไหปลาร้า สามารถใช่ในกรณีที่เต้านมมีความหย่อนยานเพียงเล็กน้อยเท่านั้น
2.การผ่าตัดเพื่อยกกระชับ วิธีนี้การตัดเอาเนื้อของนมและผิวหนังส่วนที่หย่อนยานออกไป และทำการเลื่อนตำแหน่งอขงหัวนมและลานนมให้สูงข้น ซึ่งสามารถลดขนาดลานนมและยกกระชับเต้านมได้เป็นอย่างดี ซึ่งวิธีนี้ได้รับความนิยมกันมาก
การผ่าตัดยกกระชับเป็นการผ่าตัดที่ต้องใช้ความชำนาญมากกว่าการผ่าตัด เสริมหน้าอก มาก ดังนั้นควรเลือกแพทย์ที่มีความเชี่ยวชาญและมีประสบการณ์ในการยกกระชับในการให้บริการ เพื่อผลการผ่าตัดที่ออกมาสมบูรณ์ไม่มีอาการข้างเคียงเกิดขึ้น และก่อนทำการผ่าตัดต้องทำความเข้าใจกับแพทย์ผู้ทำการผ่าตัดเสียก่อนว่าจะต้องผ่าตัดแผลลักษณะใดในการยกกระชับ ซึ่งแผลที่ใช้ในการผ่าตัดยกกระชับมีอยู่ด้วยกัน 3 แบบ คือ
1.การผ่าตัดแผลที่บริเวณรอบลานนม
2.การผ่าตัดแผลที่บริเวณรอบลานนมและแผลที่เป็นแนวตั้งจากบริเวณขอบล่างของลานนม ขึ้นมาจรดบริเวณฐานนม
3.การผ่าตัดแผลที่มีลักษณะคลายกับตัวทีคว่ำหรือคล้ายกับสมอเรือ
[adinserter name=”navtra”]
การผ่าตัดจะใช้แผลลักษณะใดก็ขึ้นอยู่กับลักษณะความหย่อยยานของเต้านมด้วย ซึ่งการยกกระชับที่ต้องการทำนั้นจำเป็นต้องมีการ เสริมหน้าอก เทียมเข้าไปอีกหรือไม่ เพราะว่าในรายที่มีเนื้อนมที่ส่วนของเต้านมเนินอกน้อยมาก การผ่าตัดเพื่อยกกระชับจะไม่สามารถทำการยกกระชับให้เต้านมเต่งตึงได้ แต่ต้องทำการ ทำนม เข้าไปร่วมด้วย เต้านมจึงจะเต่งตึงสวยงาม และโอกาสการเกิดภาวะแทรกซ้อนต่าง ๆ จะต้องเกิดขึ้นนอ้ยที่สุดด้วย เนื่องจากการผ่าตัดเพื่อยกกระชับเต้านมจะต้องมีการวางยาสลบในขณะที่ทำการผ่าตัด และหลังการผ่าตัดแพทย์จะทำการใส่สายระบายเลือดไว้ที่ส่วนในของ เต้านม และติดไว้ประมาณ 24 ชั่วโมงจึงจะนำออกและทำการปิดแผล ผู้ป่วยสามารถที่จะกลับมาพักฟื้นที่บ้านและรับประทานยาปฏิชีวนะ ยาลดอาการบวมและยาแก้ปวด หลังจากผ่าตัด 5-10 วัน แพทย์จะทำการตรวจแผลอีกครั้งเพื่อดูความเรียบร้อยของแผลที่เกิดขึ้น และหลังจากนั้น 1 เดือนผู้ป่วยสามารถทำการออกกำลังกายเบา ๆ ได้ จนผ่านไป 3 เดือนร่างกายจะกลับเข้าสู่สภาวะปกติ แม้ว่าการยกกระชับจะสามารถยกกระชับเต้านมได้แต่ด้วยอายุที่เพิ่มขึ้นเต้านมก็ย่อมที่จะมีโอกาสที่จะกลับมาหย่อนยานได้อีก ดังนั้นการเสริมขนาดของเต้านมจึงไม่ควรเสริมให้มีขนาดที่ใหญ่มากเกินไป และต้องใส่ชุดชั้นในเพื่อยกกระชับเต้านมอยู่ตลอดเวลา
การผ่าตัดเสริมหรือลดขนาดเต้านมมีทั้งข้อดีและข้อควรระวังดังนั้นก่อนที่จะทำการผ่าตัดทุกครั้ง ควรศึกษาหาข้อมูลให้ดีก่อนตัดสินใจ เพราะการผ่าตัด ทำนม ที่ดีสามารถสร้างความมั่นใจและโอกาสทางสังคมให้มากได้เช่นกัน
อ่านบทความที่เกี่ยวข้องเพิ่มเติมตามลิ้งค์ด้านล่าง